Agenția Europeană a Medicamentului (EMA) a dat undă verde pentru 10 tratamente noi, inclusiv primul spray nazal cu adrenalină pentru tratarea de urgență a reacțiilor alergice severe și primul vaccin ARN mesager împotriva virusului sincițial respirator (RSV). Acestea sunt printre cele zece medicamente pentru care experții EMA au recomandat, în luna iunie, acordarea unei autorizații de introducere pe piața Uniunii Europene. Totuși, doar unul din șase tratamente puse pe piața europeană în ultimii ani a ajuns la pacienții români.
Comitetul pentru Medicamente de Uz Uman (CHMP) din cadrul EMA se reunește la sfârșitul fiecărei luni pentru a decide dacă recomandă emiterea de autorizații pentru medicamentele care au încheiat procesul de evaluare. Decizia finală aparține Comisiei Europene, care urmează de regulă recomandările experților EMA.
În ultima reuniune din perioada 24-27 iunie, CHMP a recomandat aprobarea a 10 medicamente, inclusiv două generice și un biosimilar, și extinderea indicației terapeutice pentru alte 11 tratamente.
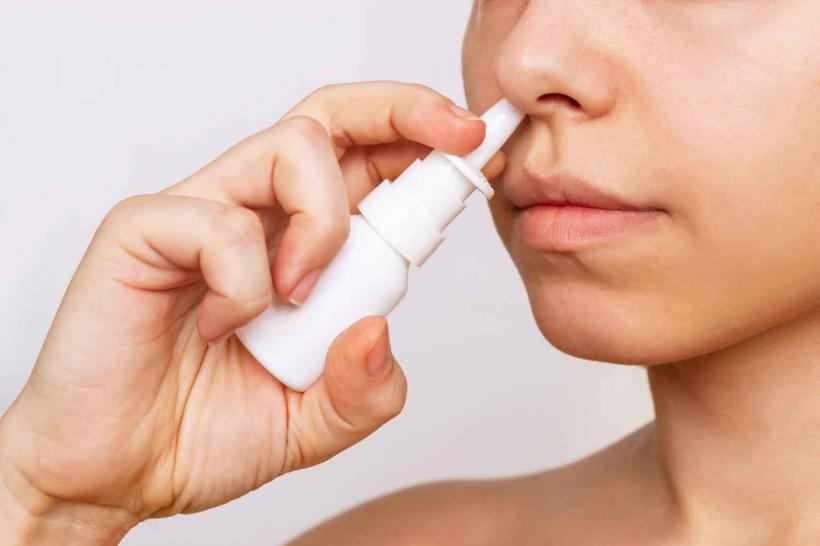
Unul dintre cele zece medicamente noi aprobate este Eurneffy (epinefrină), primul tratament de urgență pentru anafilaxie care se administrează cu ajutorul unui spray nazal. Anafilaxia este cea mai severă formă de reacție alergică, care poate fi fatală dacă nu este tratată prompt. Eurneffy oferă o alternativă pentru cei care întâmpină dificultăți în administrarea injecțiilor.
mResvia, un vaccin ARNm pentru virusul sincițial respirator (RSV), a primit aprobarea EMA. RSV este un virus extrem de contagios care cauzează infecții ale plămânilor și provoacă zeci de mii de decese anual. mResvia este primul vaccin bazat pe tehnologia ARN mesager care vizează alt agent patogen decât SARS-CoV-2.
EMA a recomandat autorizarea Winrevair (sotatercept) pentru tratamentul hipertensiunii arteriale pulmonare, o afecțiune rară și debilitantă. Sotatercept este primul inhibitor de semnalizare a activinei aprobat pentru această afecțiune, având potențialul de a îmbunătăți semnificativ prognosticul pacienților.
CHMP a recomandat, de asemenea, autorizarea următoarelor medicamente:
Balversa (erdafitinib) pentru carcinomul urotelial nerezecabil sau metastatic.
Ordspono (odronextamab), pentru limfom folicular și limfom difuz cu celule B mari.
Piasky (crovalimab) pentru hemoglobinurie paroxistică nocturnă.
Tauvid (flortaucipir) pentru tomografia cu emisie de pozitroni (PET) la pacienții cu tulburări cognitive, evaluând boala Alzheimer.
Steqeyma (ustekinumab), un biosimilar pentru boala Crohn, psoriazis în plăci și artrită psoriazică.
Enzalutamide Viatris (enzalutamidă), un generic pentru cancer de prostată.
Nilotinib Accord (nilotinib), un generic pentru leucemia mieloidă cronică cu cromozom Philadelphia pozitiv.
Acces Limitat la Medicamente Inovatoare în România
Deși EMA a aprobat 57 de medicamente noi și a extins indicațiile pentru alte 40 în prima jumătate a anului 2024, pacienții români au acces la doar 17% dintre medicamentele aprobate la nivel european între 2019 și 2022. În ianuarie 2024, doar 29 din 167 de medicamente inovatoare aprobate de EMA erau disponibile în România. Niciun medicament aprobat în 2022 nu era compensat în România.
În Europa, rata medie de disponibilitate a medicamentelor noi este de 43%, Germania având cea mai mare rată de disponibilitate (88%), urmată de Italia (77%) și Austria (75%). România se situează mult sub media europeană, cu un timp mediu de acces la medicamentele inovatoare de 778 de zile, comparativ cu 126 de zile în Germania.
În concluzie, deși EMA continuă să aprobe un număr mare de medicamente inovatoare, accesul pacienților români la aceste tratamente rămâne limitat și întârziat
CITEȘTE ȘI:Accesul românilor la medicamente inovatoare





























Fii primul care comentează